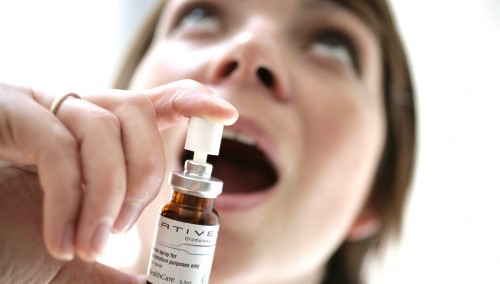
Un premier médicament à base de Cannabis, le Sativex, destiné aux malades atteints de sclérose en plaques, et commercialisé par la société Almirall, devrait apparaître sur le marché français entre 2014 et 2015. La société devra au préalable constituer un dossier d'Autorisation de mise sur le marché (AMM) à soumettre à l'Agence nationale de sécurité du médicament (ANSM) afin qu'elle lui donne le feu vert.
Depuis le 8 juin dernier, date à laquelle la France a donné son aval pour que soient évalués les dossiers d'AMM des médicaments issus de dérivés du cannabis par l'ANSM, seule une entreprise prévoit de constituer un dossier pour que sa médication soit soumise à validation.
Il s'agit de l'Almirall qui en 2010 déjà, déposait deux demandes d'AMM à l'ANSM pour le Sativex, un spray buccal thérapeutique réservé aux patients souffrant de la sclérose en plaques. Le code de la santé publique ne permettant pas la commercialisation de tels médicaments, aucune suite n'avait été donnée à sa demande.
De ce fait, cette nouvelle position de la France est « une bonne nouvelle » pour la société, d'autant plus que « Cela faisait trois ans que nous avions engagé des démarches », a déclaré Christophe Vandepuute, à la tête d'Almirall France.
Une fois l'AMM accordée, le Comité économique des produits de santé se chargera d'établir un prix de vente. La Haute autorité de santé évaluera de son côté le taux de remboursement.
Le Sativex ne devrait donc pas apparaître sur le marché « avant fin 2014, voire 2015 en pharmacie », indique le directeur d'Almirall France.
Le ministère de la Santé a été clair : « Il ne s'agit pas de dépénaliser, ni de permettre l'utilisation thérapeutique du cannabis fumé. Il s'agit de permettre l'utilisation de médicaments qui disposent d'une AMM ».
5000 patients pourraient se voir prescrire le Sativex s'il venait à être commercialisé.